 Web Content Anzeige Web Content Anzeige
MethodenDas Schicksal des vom Meeresboden aufsteigenden Methans wird vom Sediment über die Wassersäule bis hin zur Meeresoberfläche verfolgt. Dies beinhaltet sowohl in-situ Messungen durch den Einsatz von „Landern“ als auch den videoüberwachten Einsatz eines Multicorers und eines ROV zur Beprobung der Sediment/Bodenwasser-Grenzschicht sowie eine profilierende Seewasserbeprobung durch eine CTD/Rosette.
Durch das ROV Kiel 6000 kann der Meeresboden akustisch (Sonar) und optisch (Video) flächenhaft erkundet werden. Der Einsatz von Push cores, eines Porenwassersammlers und einer Temperaturlanze mittels der beiden Manipulatoren erlaubt eine gezielte Beprobung, die in Kombination mit der flächendeckenden Erkundung eine Regionalisierung der Daten ermöglichen.
Durch den Einsatz von benthischen Kammern, die entweder durch das ROV oder durch videogeführte Lander gezielt am Meeresboden positioniert werden, wird direkt vor Ort der Fluidfluss gemessen. Diese Kammern werden mit Motorkraft vorsichtig in das Sediment getrieben und nehmen in definierten Zeitabständen Wasserproben aus dem überstehenden Wasser der Kammer. Nach Ablauf der Inkubation wird das Sediment geborgen und die Proben können an Bord auf ihre chemischen Komponenten wie z.B. Sauerstoff, Methan, Sulfid, Sulfat untersucht werden. Durch die zeitliche Variation können Umsatzraten und durch numerische Modelle der Fluidfluss bestimmt werden.
Im Lander BIGO (BioGeochemisches Observatorium) können 2 Kammern gleichzeitig inkubiert werden und dabei die Sauerstoffkonzentration über ein Gasaustauschsystem kontrolliert werden.
Fig. 4: Einsatz von 2 benthischen Kammern im BIGO-Lander, rechts mit Gasaustauschersystem. Im Profiler Lander werden Mikroelektroden zur in situ Erfassung von Sauerstoff, Sulfid und pH eingesetzt. Gleichzeitig wird das Strömungsregime der Bodenwassergrenzschicht durch nach oben und nach unten gerichtete akustische Strömungssensoren (ADCPs) erfasst.
Fig. 5: Profiler Lander mit ADCPs (weiße Kreise) und Profiler, rechts Profiler mit Mikroelektroden. Auch im Labor werden Mikroelektroden zur Bestimmung von Sulfid, pH, Redoxpotenzial und Sauerstoff eingesetzt. Dies ermöglicht eine kontinuierliche Profilaufnahme von Prozessen wie der anaeroben Methanoxidation, der Sulfatreduktion und der Sulfidoxidation im Sediment sowie in Kleinstlebensräumen. Die CTD/Rosette ermöglicht Leitfähigkeits- und Temperaturmessungen über die gesamte Wassersäule. Durch seine 24 Wasserschöpfer können zusätzlich Wasserproben in verschiedenen Tiefen genommen werden, was weitere Analysen im Labor ermöglicht. Gleichzeitig kann die CTD auch mit zusätzlichen Sensoren (z.B. Sauerstoff, Methan, Trübung) ausgestattet werden, um die Detektion und Beprobung von Methananomalien in der Wassersäule zu ermöglichen. Die Wasserproben werden an Bord entgast und die gelösten Gase in Hinblick auf ihre Methankonzentration im Gaschromatographen (GC) analysiert. Ebenso werden die gelösten Gase aus den Sedimenten extrahiert und das Verhältnis von Methan zu höheren Kohlenwasserstoffen sowohl im Porenwasser als auch in der Wassersäule über den „Cold seep“ Gebieten bestimmt.
Die Zusammensetzung von stabilen Kohlenstoff-Isotopen im Gas werden im Labor des IFM-GEOMAR an einem Massenspektrometer (GC-irMS) bestimmt, um Aussagen über die Herkunft der Fluide machen zu können.
Um die Umsatzraten von AOM und SR zu erhalten werden radioaktive Tracer ( 14CH4 und 35SO42-) eingesetzt. Zu diesem Zweck werden mit Pushcores vertikale Unterproben aus den Sedimentkernen genommen. In 1 cm Abständen werden die Radiotracer injiziert und für 24 Std. anoxisch, dunkel und bei der in situ Temperatur des Sediments inkubiert. Nach der Inkubationszeit wird durch Zinkacetat oder Natriumhydroxid jegliche Bioaktivität gestoppt. Die Konzentration/Aktivität der Radiotracer wird im Ausgangs- und Endprodukt der Reaktion durch einen Szintillation-Counter bestimmt. Durch den Vergleich der Tracerkonzentration zur Gesamtkonzentration wird die Berechnung der Umsatzraten möglich.
Zur Identifizierung und Quantifizierung der Mikroorganismen wird die Fluoreszenz in-vitro hybridization (FISH) Methode genutzt. Dazu wird die gesamte Probe fixiert und die Zellen permeabilisiert, bevor die Hybridisierung durchgeführt wird. Die Oligonukleotidsonde besteht aus der „Horseradish Perdoxidase“ und einer Basensequenz, die sich mit der rRNA der mikrobiellen Gruppe verbindet. Nach einer Signalverstärkung durch Tyramid, ist es möglich, die Zellen zu mikroskopieren und ihre Dichte zu bestimmen. Es können verschiedene mikrobielle Gruppen eingefärbt werden, um den syntrophischen Partner zu lokalisieren. Durch die DAPI-Methode, die die DNS jeder Zelle anfärbt, wird diese Technik überprüft.
Abb. 9: Gefärbte ANME-2, links durch Cy-3 und rechts durch DAPI Um ein besseres Verständnis der Kontrollparameter und der Dynamik des benthischen Filters zu erhalten, wird ein Sediment-Durchflusssystem verwendet. Dieses System umfasst zwei unterschiedliche Seewassermedien. Das erste, welches von oben zugeführt wird, enthält Sulfat und das zweite Methan, das durch eine Methanatmosphäre angereichert wird. Beide Medien werden durch eine Stickstoffatmosphäre anoxisch gehalten. Pumpen befördern die Medien in den Sedimentkern, der in einem Inkubator untergebracht ist. Der Auslauf befindet sich oben, sodass das Methanmedium advektiv durch den Kern gepumpt wird, während das Sulfatmedium nur durch Diffusion in das Sediment eindringen kann.
Durch unterschiedliche in-vitro Experimente wird die Interaktion zwischen Sediment und Mikroorganismen sowie ihre Reaktionszeit untersucht. In diesen Experimenten werden abiotische Faktoren wie pH, Temperatur, Alkalinität und der advektive Fluss sowie die Konzentrationen von Methan, Sulfat und Sulfid variiert. Beprobungslöcher im Sedimentkern ermöglichen eine umfassende Beobachtung dieser Parameter und der Zelldichte der Archaeen und Bakterien in unterschiedlichen Sedimenttiefen. Bestimmt werden diese Parameter durch Mikrosensoren, Porenwasseranalysen und FISH. Alle genannten Methoden werden zur Entwicklung eines Numerischen Modells verwendet, mit welchem die Bedeutung der Transportprozesse für die Verteilung der Biomasse, Raten der anaeroben Methanoxidation und der Methanfluss aus dem Meeresboden abgeschätzt werden soll. Insgesamt werden durch diese Vorgehensweise verschiedene zeitgemäße in-situ, ex-situ und in-vitro Methoden sowie numerische Modellierung kombiniert, um das Schicksal des Methans aus unterschiedlichen Perspektiven zu erforschen. Durch den Vergleich der erhaltenen Informationen mit Messungen an anderen Standorten sollen Lücken im globalen Budget geschlossen werden.
|
 Events Events
Kieler Wissenschaftler fühlen den 'Puls der Erde' Wie funktioniert die Recyclingmaschine der Erde?Nach elf Jahren endet der Kieler Sonderforschungsbereich 574 zu Subduktionszonen Final colloquium of SFB 574 Teilprojekt ÖffentlichkeitsarbeitMEERESFORSCHUNG FÜR MICH UND DICH |
|||||||
©SFB574 // Wischhofstrasse 1-3 // D-24148 Kiel // T. +49 (0)431 600 1413 // elange [AT] geomar.de






 Fig. 1: Einsatz des videogeführten Multicorers
Fig. 1: Einsatz des videogeführten Multicorers
 Fig. 3: Einsatz einer benthischen Kammer durch das ROV.
Fig. 3: Einsatz einer benthischen Kammer durch das ROV.




 Fig. 7: Aufbau der GC-C-irMS zur Bestimmung des δ13C, oben der GC und darunter das Massenspektrometer.
Fig. 7: Aufbau der GC-C-irMS zur Bestimmung des δ13C, oben der GC und darunter das Massenspektrometer. Abb. 8: Bestimmung der Sulfatreduktion
Abb. 8: Bestimmung der Sulfatreduktion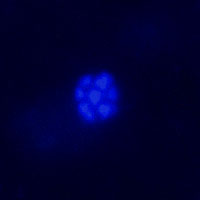
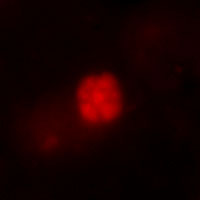
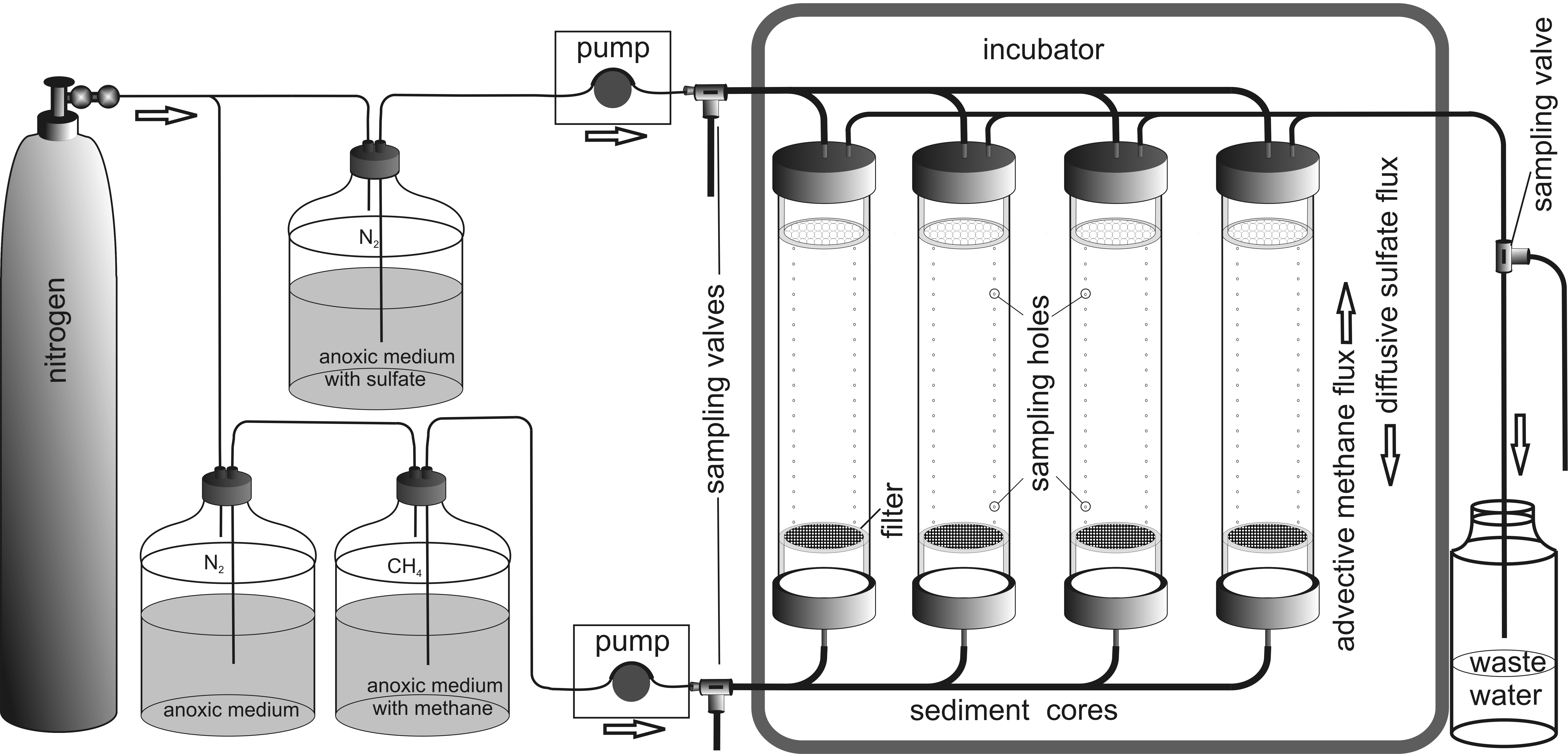 Abb. 10: Schematische Darstellung des Sediment-Durchflusssystems
Abb. 10: Schematische Darstellung des Sediment-Durchflusssystems